Pengertian
Termodinamika
Termodinamika adalah ilmu tentang
energi, yang secara spesifik membahas tentang hubungan antara energi panas
dengan kerja. Seperti telah diketahui bahwa energi didalam alam dapat terwujud
dalam berbagai bentuk, selain energi panas dan kerja, yaitu energi kimia,
energi listrik, energi nuklir, energi gelombang elektromagnit, energi akibat
gaya magnit, dan lain-lain . Energi dapat berubah dari satu bentuk ke bentuk
lain, baik secara alami maupun hasil rekayasa tehnologi. Selain itu energi di
alam semesta bersifat kekal, tidak dapat dibangkitkan atau dihilangkan, yang
terjadi adalah perubahan energi dari satu bentuk menjadi bentuk lain tanpa ada
pengurangan atau penambahan. Prinsip ini disebut sebagai prinsip konservasi
atau kekekalan energi. Prinsip thermodinamika tersebut sebenarnya telah terjadi
secara alami dalam kehidupan sehari-hari. Bumi setiap hari menerima energi
gelombang elektromagnetik dari matahari, dan dibumi energi tersebut berubah
menjadi energi panas, energi angin, gelombang laut, proses pertumbuhan berbagai
tumbuh-tumbuhan dan banyak proses alam lainnya. Proses didalam diri manusia
juga merupakan proses konversi energi yang kompleks, dari input energi kimia
dalam maka nan menjadi energi gerak berupa segala kegiatan fisik manusia, dan
energi yang sangat bernilai yaitu energi pikiran kita. Dengan berkembangnya
ilmu pengetahuan dan teknologi, maka prinsip alamiah dalam berbagai proses
thermodinamika direkayasa menjadi berbagai bentuk mekanisme untuk membantu
manusia dalam menjalankan kegiatannya.
Klasifikasi
Sistem Termodinamika
Suatu sistem thermodinamika
adalah sustu masa atau daerah yang dipilih, untuk dijadikan obyek analisis.
Daerah sekitar sistem tersebut disebut sebagai lingkungan. Batas antara sistem
dengan lingkungannya disebut batas sistem.
1. Sistem
tertutup.
Merupakan sistem massa tetap dan identitas batas sistem
ditentukan oleh ruang zat yang menempatinya. Contoh sistem tertutup adalah
suatu balon udara yang dipanaskan, dimana masa udara didalam balon tetap,
tetapi volumenya berubah, dan energi panas masuk kedalam masa udara didalam
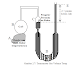
balon Sistem tertutup ditunjukkan oleh gambar 1. Gas di dalam silinder dianggap
sebagai suatu sistem. Jika panas diberikan ke silinder dari sumber luar,
temperatur gas akan naik dan piston bergerak ke atas.
2. Sistem terbuka
Pada sistem ini, zat melewati batas sistem. Panas dan kerja
bisa juga melewati batas sistem.
3. Sistem terisolasi
Adalah sebuah sistem yang sama sekali tidak dipengaruhi oleh
lingkungannya. Sistem ini massanya tetap dan tidak ada panas atau kerja yang
melewati batas sistem.
HUKUM-HUKUM TERMODINAMIKA
Hukum Ke-nol Termodinamika
Hukum ini berbunyi: “Jika dua
benda berada dalam kondisi kesetimbangan termal dengan benda ketiga, maka
benda-benda tersebut berada dalam kesetimbangan termal satu sama lainnya”.
Hukum l Termodinamika
Jika kalor diberikan
kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat
mengembang dan bertambah panas), sebaliknya, jika kalor diambil dari sistem,
volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih
dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk
dari hukum kekekalan energi.
Sistem yang mengalami perubahan
volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan
mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan
menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam.
Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau
disebut Hukum 1 Termodinamika. Secara matematis hukum l termodinamika
dituliskan sebagai berikut :
ΔU = Q - W
Keterangan :
ΔU = U2 —U1=perubahan energi dalam sistem
Q = kalor yang diterima atau dilepaskan olehsistem
(Joule)
W = usaha yang dilakukan sistem (Newton)
Contoh Soal
Gas dengan volume 0,3 liter dipanaskan pada tekanan tetap
2,0 atm sehingga volumenya menjadi 0,8 liter. Tentukan usaha yang dilakukan
oleh gas.
Penyelesaian :
dik : Volume awal V1 = 0,3 L
Volume akhir V2
= 0,8 L
Tekanan , P = 2,0 atm
maka :
W = pΔV = p( V1
- V2 )
= 0,2 atm
(0,8 L - 0,3 L)
= 1,0 L atm
Hukum II Termodinamika
Hukum ini berbunyi: “Ada batas
tertentu dari jumlah energi mekanik, yang diperoleh dari sejumlah energi
panas”.
Pada umumnya perubahan yang
terjadi di alam disertai dengan perubahan energi. Dalam proses perubahan energi
ini ada dua aspek penting, yaitu arahpemindahan energi dan pengubahan energi
dari satu bentuk ke bentuk yang lain.Walaupun hukum pertama termodinamika
menetapkan hubungan antara kalor yangdiserap dengan kerja yang dilakukan oleh
sistem, tetapi hukum ini tidak menunjukkanbatas-batas mengenai sumber maupun
arah aliran energi.Hukum kedua termodinamika dirumuskan untuk menyatakan
pembatasan-pembatasan yang berhubungan dengan pengubahan kalor menjadi kerja,
dan jugauntuk menunjukkan arah perubahan proses di alam. Dalam bentuknya yang
palingumum, hukum kedua termodinamika dirumuskan dengan mempergunakan suatu
fungsi keadaan yang disebut entropi.
Jika ∆ S as ialah perubahan entropi yangterjadi di
alam semesta, maka bagi setiap proses spontan berlaku, ∆S as > 0.Dengan
memandang alam semesta itu sebagai sistem dan lingkungan, maka dapatpula
dikatakan bahwa untuk semua proses spontan berlaku,
∆S Sistem + ∆S lingkungan > 0
dengan ∆S sistemialah perubahan entropi sistem dan ∆S
lingkungan ialah perubahan entropi lingkungan.
Proses dalam Termodinamika
Terdapat empat proses dalam gas
pada bahasan termodinamika. Pada pembahasan Bab 8, Anda telah mengenal tiga
proses, yaitu isotermal, isobarik, dan isokhorik. Proses yang keempat adalah
proses adiabatik. Usaha yang terdapat pada gas yang mengalami proses-proses
termodinamika tersebut akan diuraikan sebagai berikut.
a. Proses Isotermal
Proses isotermal adalah suatu proses perubahan keadaan gas
pada suhu tetap.
Menurut Hukum Boyle, proses isotermal dapat dinyatakan
dengan persamaan :
pV = konstan
atau
p1V1 = p2V2
Dalam proses ini, tekanan dan volume sistem berubah sehingga
persamaan W = p ΔV tidak dapat langsung digunakan. Untuk menghitung usaha
sistem dalam proses isotermal ini digunakan cara integral. Misalkan, pada
sistem terjadi perubahan yang sangat kecil sehingga persamaan usahanya dapat
dituliskan sebagai
Jika konstanta n R, dan besaran suhu (T) yang nilainya tetap
dikeluarkan dari integral, akan diperoleh :
W = nR T (lnV2 – lnV1)
W = n RT ln (V2/V1)
atau
W = n RT ln (p2/p1)
Contoh Soal
:
Sepuluh mol gas helium memuai secara isotermal pada suhu 47
°C sehingga volumenya menjadi dua kali volume mula-mula. Tentukanlah usaha yang
dilakukan oleh gas helium.
Penyelesaian
:
Diketahui: T = 47 °C = (47 + 273) K = 320 K dan V2 =
2V1.
Usaha yang dilakukan gas pada proses isotermal:
W = n RT ln (V2/V1) = (10 mol) ( 8,31 J/mol)(320 K) ln
(2V2/V1) = 26.592 ln 2 = 18.428 joule
b. Proses Isokhorik
Proses isokhorik adalah suatu proses perubahan keadaan gas
pada volume tetap.
Menurut Hukum Gay-Lussac proses isokhorik pada gas dapat
dinyatakan dengan persamaan :
p/T = konstan
atau
p1/T1 = p2/T2
Oleh karena perubahan volume dalam proses isokhorik ΔV = 0
maka usahanya W = 0.
c. Proses Isobarik
Proses isobarik adalah suatu proses perubahan keadaan gas
pada tekanan tetap.
Menurut Hukum Charles, persamaan keadaan gas pada proses
isobarik dinyatakan dengan persamaan :
V/T = konstan
atau
V1/T1 = V2/T2
Oleh karena volume sistem berubah, sedangkan tekanannya
tetap, usaha yang dilakukan oleh sistem dinyatakan dengan persamaan :
W = pΔV = p (V2 – V1)
Contoh Soal
:
Suatu gas yang volumenya 1,2 liter perlahan-lahan dipanaskan
pada tekanan tetap 1,5 × 105 N/m2 hingga volumenya menjadi 2 liter. Berapakah
usaha yang dilakukan gas?
Penyelesaian :
Diketahui: V1 = 1,2 L, V2 = 2 L, dan p = 1,5 × 105 N/m2.
1
liter = 1 dm3 = 10–3 m3
Usaha yang dilakukan gas pada tekanan tetap (isobarik)
adalah
W = p (V2 – V1) = (1,5 × 105 N/m2) (2 – 1,2) × 10–3 m3 =
120 joule
d. Proses Adiabatik
Proses
adiabatik adalah suatu proses perubahan keadaan gas di mana tidak ada kalor (Q)
yang masuk atau keluar dari sistem (gas). Proses ini dapat dilakukan dengan
cara mengisolasi sistem menggunakan bahan yang tidak mudah menghantarkan kalor
atau disebut juga bahan adiabatik. Adapun, bahan-bahan yang bersifat mudah
menghantarkan kalor disebut bahan diatermik Proses adiabatik ini mengikuti
persamaan Poisson sebagai berikut
p Vγ = konstan
atau
p1 V1γ = p2 V2γ
Oleh karena persamaan gas ideal
dinyatakan sebagai pV = nRT maka Persamaan (9–4) dapat ditulis :
T1V1(γ –1) = T2 V2(γ
–1)
dengan γ = CP/CV =
konstanta Laplace, dan CP/CV > 1. CP adalah kapasitas kalor gas
pada tekanan tetap dan CV adalah kalor gas pada volume tetap.
Perhatikan diagram p – V pada Gambar 7.
Oleh karena sistem tidak
melepaskan atau menerima kalor, pada kalor sistem proses adiabatik Q sama
dengan nol. Dengan demikian, usaha yang dilakukan oleh sistem hanya mengubah
energi dalam sistem tersebut. Besarnya usaha pada proses adiabatik tersebut
dinyatakan dengan persamaan berikut :
W=
3/2 nRT−T = 3/2 (p1 V1 − p2 V2)